In der Wildnis, am Labortisch und mit Computerdaten untersuchen Forschende aus Berlin, wie sich Viren und Bakterien an den menschlichen Organismus angepasst haben – und bis heute jede Lücke des Immunsystems ausnutzen. Ihre Erkenntnisse sollen auch dazu beitragen, neuen Pandemien vorzubeugen
Text: Till Hein
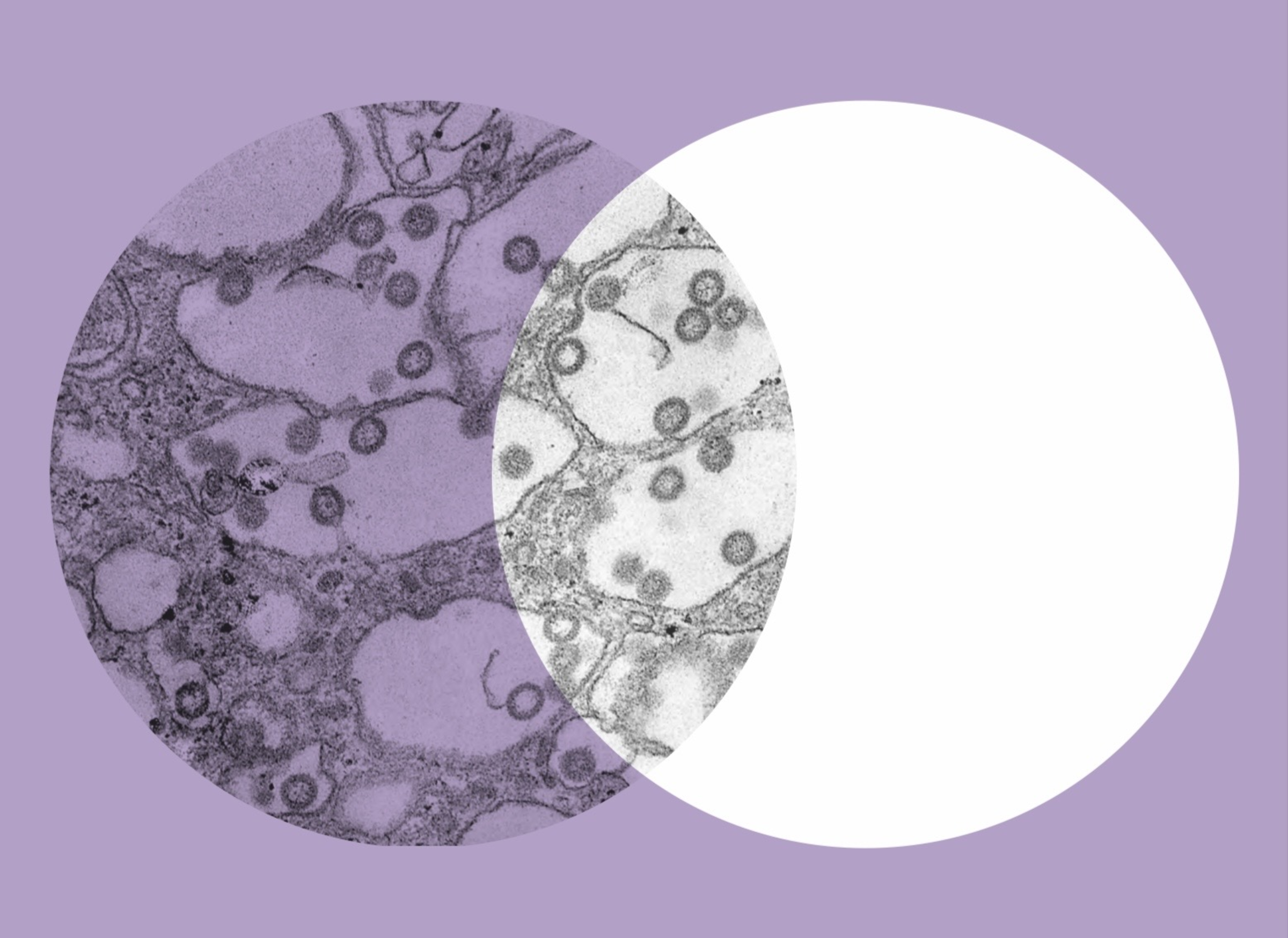
Es ist ein heroischer Kampf gegen eine unsichtbare Übermacht. Denn weltweit gibt es mehr Viren als Lebewesen. Im Wasser, an Land und in der Luft. Und für ihre rasend schnelle Weiterverbreitung reicht es aus, wenn es einer von einer Million dieser winzig kleinen Erreger es schafft, in eine Körperzelle vorzudringen: Viren gehen dann vorübergehend in dieser Wirtszelle auf und können ihr Erbgut weitergeben. Bis zu 100.000 Kopien ihrer DNA erzeugen sie, befallen die benachbarten Zellen und programmieren auch diese um. Für die Wirte kann das lebensbedrohlich sein. Beim Menschen lösen sie Krankheiten wie Covid-19, Masern oder schwere Infekte der Atemwege aus. Andere aktivieren Krebs auslösende Gene, Onkogene genannt.
Berliner Wissenschaftler wollen verstehen, was Viren und Bakterien zu der feindlichen Übernahme antreibt und welche Faktoren ihren Erfolg begünstigen, um sie besser abzuwehren – und neuen Pandemien vorzubeugen. Dafür schauen sich auch weit in die Vergangenheit und analysieren, wie frühere Seuchen sich ausgebreitet haben. „Viele Krankheitserreger sind ursprünglich von Tieren auf den Menschen übergesprungen“, weiß der Bioinformatiker Amr Aswad. Ob das auch für das Coronavirus gilt, wie viele Fachleute vermuten, lässt sich bis heute nicht beweisen. Gut belegt ist aber, dass rund 70 Prozent aller Infektionserreger von Humanerkrankungen ursprünglich aus dem Tierreich stammen, darunter HIV, Ebola, Influenza und SARS.
Viren und ihre Wirte befinden sich in einem ständigen evolutionären Krieg
Amr Aswad, der 2018 als Einstein International Postdoctoral Fellow von der University of Oxford an die Freie Universität Berlin (FU) kam, will herausfinden, wie sich die Erreger an den menschlichen Organismus angepasst haben. In erster Linie erforscht er Herpesviren. „Mindestens neun Arten dieser Viren können bei Menschen Krankheiten auslösen“, sagt er. Am bekanntesten sind die lästigen, aber harmlosen „Fieberbläschen“ an den Lippen. Herpesviren, die viele Leute als schlummernde Infektion in sich tragen, können, wenn das Immunsystem geschwächt ist, aber auch schwere Krankheiten wie Meningitis, Gürtelrose oder Pfeiffersches Drüsenfieber verursachen, so Aswad.
Das Forschungsgebiet, auf das er sich spezialisiert hat, heißt Paläovirologie, („palaios“ bedeutet im Altgriechischen „alt“). Die Familie der Herpesviren eignet sich da erstklassig als Studienobjekt – denn es gibt sie bereits seit rund 400 Millionen Jahren. Sie sind also überaus erfolgreich mit ihrer Taktik. Wenn Aswad den Verlauf einer Herpesinfektion beschreibt, klingt das wie eine Szene aus einem Horrorfilm: „Ich sehe eine Armee von ikosaederförmigen Herpesviren, die über eine Zelloberfläche schwärmen“, sagt er. „Dann entpackt sich ein Viruspartikel, wie eine Maschine, die sich selbst zerstört.“ Schließlich krieche das virale Genom um den Zellkern herum, nähere sich dem Rand eines Chromosoms und dringe dort ein.
Praktisch alle Wirbeltiere sind anfällig für Infektionen mit Herpesviren. Und Amr Aswad und sein Team konnten durch die Analyse von Genomsequenzen hunderttausender Viren aus unterschiedlichen Epochen der Weltgeschichte nachweisen, dass einige Herpesviren ihre DNA bereits in menschliche Chromosomen integriert haben, bevor der Homo sapiens Afrika verließ – also vor etwa 100.000 Jahren – und seither von Generation zu Generation weitergegeben werden.
Alle Arten von Viren sind in das Genom ihres Wirts integriert und werden seit Jahrmillionen vererbt. In gewisser Weise sind alle Menschen und Tiere wandelnde Archive alter Infektionen
Häufig kommt es bei Viren zu kleinen Fehlleistungen: Sie kopieren dann in einem fremden Organismus zum Beispiel nicht nur ihre eigene DNA, sondern versehentlich auch Informationen aus dem Genom der Wirtszelle. Im Erbgut der nächsten Wirtszelle kann diese eingeschleppte DNA dann fixiert – und damit Teil des Genoms des Wirts werden. Viren sind somit ein wichtiger Antreiber der Evolution. Aber eben auch ein Risiko für die Entstehung neuer Seuchen.
Wie ein Detektiv verfolgt Aswad solche Mutationen bis in graue Vorzeit zurück. „Alle Arten von Viren sind in das Genom ihres Wirts integriert und werden seit Jahrmillionen vererbt“, erzählt er. „In gewisser Weise sind alle Menschen und Tiere wandelnde Archive alter Infektionen.“ Anhand von DNA-Sequenzen, die er am Computerbildschirm miteinander vergleicht, rekonstruiert er die Evolutionsgeschichte von Herpesviren. „Wir müssen genau wissen, welche Teile identisch sind und welche sich unterscheiden“, sagt er. „Erst dann können wir uns der Frage zuwenden, warum das so ist.“ Und so auch verstehen, warum ein Virus zum Beispiel plötzlich gefährlicher wird.
„Viren und ihre Wirte befinden sich in einem ständigen evolutionären Krieg“, erklärt der Bioinformatiker. Jede Partei versuche, die andere zu überlisten, indem sie neue Angriffs- oder Verteidigungsmethoden entwickle. „Am Ende gewinnt entweder eine der beiden Parteien - was zum Aussterben der anderen führt“, sagt Amr Aswad. „Oder beide Seiten finden schließlich ein Gleichgewicht und koexistieren: so wie zum Beispiel Herpesviren und Menschen.“ Er ist überzeugt, dass die Paläovirologie zu einem besseren Verständnis neuer Krankheitserreger und Pandemien beitragen kann. „Je mehr wir über die Evolution der verschiedenen Virusfamilien wissen, desto besser können wir uns gegen künftige Infektionsausbrüche wappnen“, sagt er. Gefährliche neue Viren könnten so frühzeitig erkannt und Abwehrmaßnahmen rechtzeitig ergriffen werden.
Krankheitsbilder seit der Steinzeit auf einen Blick
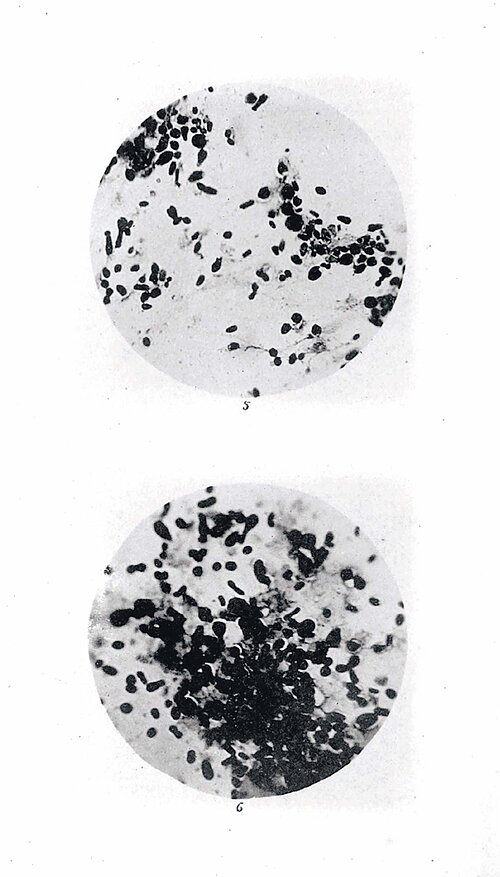
Felix M. Key, Leiter der Forschungsgruppe Evolutionäre Pathogenomik am Max-Planck-Institut für Infektionsbiologie (MPIIB), verfolgt ähnliche Ziele. Er und sein Team konzentrieren sich jedoch vor allem auf Bakterien. „Erreger wie Pest, Tuberkulose und Salmonellen begleiten die Menschheit schon seit Tausenden von Jahren“, sagt der Mikrobiologe und Bioinformatiker. „Sie sind also extrem erfolgreich.“ Er analysiert die genetischen Veränderungen, die zum Siegeszug und zur Dauerpräsenz solcher Keime beigetragen haben, um daraus Rückschlüsse auf die Gegenwart ziehen.
Key arbeitet eng mit Archäologinnen zusammen, die Skelette aus fernen Jahrhunderten auf Krankheiten untersuchen. „Zähne eignen sich dafür oft am besten“, erzählt Key. „Sie sind durchblutet und können daher auch Krankheitserreger enthalten, die zum Todeszeitpunkt im Blut vorkamen.“ Nach dem Tod eines Individuums wirken Zähne wie ein Tresor, aus dem Keime nicht durch Wind und Wetter ausgewaschen werden. „Mit etwas Glück findet man auch nach etlichen Jahrhunderten DNA-Schnipsel des Erregers und kann dadurch etwas über die entsprechende Krankheit lernen.“ 2015 haben Forscher aus Dänemark etwa nachgewiesen, dass Yersinia pestis, das Bakterium, dass die Pest ausgelöst hat, viel älter ist als gedacht. Aus 5000 Jahre alten Proben aus der Bronzezeit wurde eine Pest-Art extrahiert, die heute nicht mehr existiert.
Key und sein Team beschäftigen aber nicht nur Erkrankungen und evolutionäre Prozesse, die gefühlte Ewigkeiten zurückliegen. „Manche Bakterien können innerhalb sehr kurzer Zeit neue Nischen in Menschen erobern“, erzählt er. Mit Hilfe von Hochdurchsatzsequenzierung beobachten die Forschenden etwa, wie sich Bakterien unseres eigenen Mikrobioms – die beispielsweise in unserem Magen-Darmtrakt leben und viele positive Effekte haben – innerhalb weniger Tage verändern können und uns dadurch auf einmal krank machen. „Alle Menschen haben Billionen von Bakterien in und an sich, welche täglich über eine Milliarde Mutationen generieren“, sagt er. „Wir versuchen zu verstehen, wie diese Mutationen dazu beitragen, dass uns Bakterien, die wir in uns tragen, infizieren können.“
Durch die computergestützte Untersuchung der DNA der vielen unterschiedlichen Bakterien, die Krankheiten auslösen können, wollen die Forschenden Muster finden, die über Anpassungsprozesse der Keime an Umweltbedingungen Aufschluss geben, zum Beispiel darüber, wie sie Resistenzen gegen Antibiotika entwickeln konnten. Die riesigen Datensätze lassen sich mit bloßem Auge nicht erfassen. „Ein Großteil meiner Arbeit besteht darin, Daten geschickt zusammenzufassen und zu visualisieren“, sagt Key. So würde die Biologie hinter den Zahlenbergen oft schlagartig sichtbar – und verständlich. Inzwischen gebe es Computersoftware, die es ermögliche, tausende Datensätzen gleichzeitig nach Erregern zu durchsuchen. „Man drückt „enter“ und sieht nach wenigen Minuten die Krankheitsbilder der letzten 10.000 Jahre vor sich – seit der Steinzeit. Beeindruckend.“
Alle Menschen haben Billionen von Bakterien in und an sich, welche täglich über eine Milliarde Mutationen generieren
Um den Strategien von Bakterien auf die Spur zu kommen, untersucht Felix. M. Key auch Abstriche von Patienten, die unter Infektionen mit sogenannten Krankenhaus-Keimen leiden. Werden kranke Patienten ins Spital eingewiesen wird, entwickelt sie dort nicht selten zusätzlich noch eine Infektion. Bislang nimmt man an, dass sie sich dann mit Bakterien angesteckt haben, die es vermehrt in Krankenhäusern gibt – zum Beispiel mit dem multiresistenten Keim MRSA, gegen den keine Antibiotika wirken. Vielleicht aber bringt so mancher Patient die entscheidenden Krankheitserreger selbst mit – und diese nutzen nur die Gunst der Stunde, um eine Infektion auszulösen? Erste Resultate stützen die These, dass häufig die „eigenen“ Bakterien krank machen. Zum Beispiel können Keime aus dem Darm in die Lunge überwandern und dort Entzündungen auslösen.
Mit Lockstoffen neue Krankheitserreger in Wildtieren aufspüren
Doch potenziell gefährliche Erreger lauern auch in der Umwelt. Sandra Junglen vom Institut für Virologie der Charité beschäftigt vor allem das steigende Risiko, dass Viren von Wildtieren auf Menschen überspringen können. Häufig jagen sie und ihr Team in Zusammenarbeit mit Forschenden aus Afrika in tropischen Regionen nach Viren, die von Zecken, Sandfliegen oder Mücken übertragen werden. In Regenwäldern sowie in angrenzenden Gebieten – also in vom Menschen geprägten Wäldern, an Ackerflächen, auf Weideland oder in Siedlungen – stellen sie mit Lockstoffen gefüllte Fallen auf. „Wir wollen herausfinden, wie sich die Verbreitung solcher Insekten über die verschiedenen Landschaftsformen hinweg verändert“, erklärt die Virologin. Besonders interessiert sie, welche Erreger in welcher Insektenart vorkommen. „Wenn eine Mücke kurz zuvor Blut gesaugt hat, können wir mit ein wenig Glück sogar noch sehen, von welchem Tier das Blut stammt“, erklärt sie. „Das kann ein Hinweis darauf sein, welches der natürliche Wirt des Erregers ist.“
Oft entdecken die Virologin und ihr Team Krankheitserreger, die zuvor noch nie gesichtet wurden. Manche aber sind mit bekannten Erregern von Humankrankheiten verwandt. Junglen erforscht zum Beispiel Viren, die durch winzige Sandfliegen übertragen werden und das im Mittelmeerraum weit verbreitete Sandfliegenfieber auslösen können. Eine Erkrankung, die sich meist durch Fieber, Kopfschmerzen und Entzündungen des Magen-Darm-Trakts bemerkbar macht. Es kann aber auch zu schwereren Verläufen mit Sehstörungen, Lähmungserscheinungen und Entzündungen des Gehirns kommen. Ausgelöst wird die Krankheit durch sogenannte Phleboviren, die durch Stiche von Sandfliegen in den Körper von Menschen gelangen.
Wer Pandemien verhindern will, muss ursprüngliche Lebensräume wie die Regenwälder erhalten
Unlängst stießen Junglen und ihr Team gemeinsam mit Forschenden aus Nairobi in Sandfliegen aus Ostafrika auf vier neue Phleboviren. Sie vermuten, dass diese bei Menschen sehr ähnliche Symptome auslösen können, wie die altbekannten Sandfliegenfieberviren. „Mit den bisher verfügbaren diagnostischen Tests können sie aber nicht erfasst werden“, sagt Sandra Junglen. Sie hofft, dass ihre Forschung dabei helfen wird, die Diagnosemöglichkeiten bei Fiebererkrankungen mit unbekannter Ursache zu verbessern.
Eine weitere zentrale Fragestellung: Wie lässt sich das Risiko für künftige Seuchen reduzieren? „Damit es zu einer Pandemie kommen kann, müssen Viren nicht nur von Tieren auf Menschen gelangen, sondern auch von Mensch zu Mensch übertragbar sein“, erklärt die Expertin. „Für beides müssen sie sich in der Regel anpassen und oft braucht es dafür mehrere Anläufe über einen längeren Zeitraum hinweg.“ Klingt erst einmal wenig bedrohlich. „Je häufiger ein Erreger aber vorkommt, desto mehr Chancen gibt es für eine Übertragung“, so Junglen. „Ein Virus kann also deutlich leichter überspringen, wenn es sich in der ursprünglichen Wirtspopulation bereits weit ausgebreitet hat.“ Wo Tiere sehr dicht zusammengedrängt werden – zum Beispiel durch landwirtschaftliche Massentierhaltung, weil ihr Lebensraum schrumpft – sei das häufig der Fall.
„In einem intakten Ökosystem stehen die Arten miteinander in komplexen Beziehungen und regulieren sich gegenseitig, zum Beispiel über Nahrungsketten“, erklärt die Virologin. Gefährlich werde es dagegen häufig, wenn die Individuen einzelner Arten zu zahlreich werden. „Ökosysteme, die aus dem Gleichgewicht geraten, sind erhebliche Risikofaktoren“, warnt Junglen. „Wer Pandemien verhindern will, muss ursprüngliche Lebensräume wie die Regenwälder erhalten. Denn deren Zerstörung und der damit einhergehende Verlust der Artenvielfalt begünstigen neuartige Infektionserkrankungen, die den Menschen befallen können.“
Es ist ein harter Kampf an vielen Fronten. Aber Sandra Junglen und ihre Kollegen Felix M. Key und Amr Aswad werden nicht lockerlassen.
Stand: Dezember 2022

